Diagnosis
In order to establish an accurate diagnosis of the respective etiology and potential complications, detailed information must be obtained on the following topics: a comprehensive clinical history extending as far back as the onset of the diarrheal illness; prior dietary history; breastfeeding history; socioeconomic status and living conditions; and prior medical history, including prior infectious diseases and family history. History and physical examination can provide an outline of the profile of a patient’s nutritional status and other consequences of the diarrheal illness. The laboratory investigation should include a stool culture and a search for ova and parasites in fresh stool specimens, a detection of fecal pH and reducing substances search in the stools, a search for leukocytes and occult blood in the stools, and a determination of fecal α1 anti-trypsin and steatocrit.
Considering the high prevalence of carbohydrate intolerance in the diet reported in PD patients as a perpetuating factor of diarrhea, the approach should include overload tests with the various carbohydrates commonly used in the diet, such as lactose, glucose, and fructose. The lactulose load test should also be carried out in order to detect a possible bacterial overgrowth in the small intestine. All these tests should preferably be carried out by the technique of the H2 breath test, because this is a noninvasive method with high sensitivity and specificity [47].
If possible, the determination of fecal electrolytes should also be done, which will distinguish osmotic from secretory diarrhea [48]. In many cases, a small bowel biopsy should be performed to evaluate the mucosal architecture and the inflammatory infiltrate in the lamina propria, to investigate specific causes, and to demonstrate the extent of intestinal damage [49]. The knowledge of the intensity and extension of morphological damage enables the appropriate dietary management approach. When concurrent rectal bleeding occurs, it may be necessary to perform a rectal biopsy to evaluate the degree and type of inflammation [50].
Management
The importance of proper rehydration and dietary management during the acute diarrheic episode for preventing the progression to PD is well-known [51]. Antibiotic treatment is recommended only for prolonged infection caused by Salmonella, Giardia, Cyclospora, and EAEC (the latter especially if the infant is less than 3 months old or malnourished, immunodeppressed, or shows signs of systemic disease) [52] and in the presence of bloody diarrhea when Shigella is isolated in the stools [53]. The decision to prescribe antibiotics is limited to laboratory evidence of the enteropathogen and type of microbial resistance [54, 55].
Although ready-to-use therapeutic food (RUTF) has greatly improved the capacity for rapid catch-up growth in both the hospital and community, it is necessary to focus more on the initial diets of unwell children with nutritional aggravation, due to the persistence of diarrhea and malabsorption of the nutrients. Fasting is clearly deleterious for such children, as the practice of resuscitation on children’s wards with IV fluids, minerals, vitamins, and antibiotics (without milk or equivalent) has shown. Small, frequent feeding is crucial, but volumes may need to be individualized, which makes it very difficult for pediatric wards with a scarcity of nursing resources, especially during evening and night shifts. WHO guidelines recommend the use of F75 formula, following research done >30 years ago [56]. But now there is a clearer concept of the gut in malnutrition due to the persistence of diarrhea, so better diets are available in the market. Osmolality, in particular, may be important. F75 has an osmolality of 333 mOsmol/L, while there are commercial lactose-free formulas with 160 mOsmol/L [57].
The use of an extensive hydrolyzed protein formula or even a mixture of amino acids based formula is indicated in the following clinical circumstances: (1) acute diarrhea in infants under 6 months or less than 1 year of age with severe malnutrition, associated with dehydration and/or metabolic disorders; (2) PD with aggravation of the nutritional status or frequent recurrence of dehydration and/or metabolic acidosis [58].
The prescription of zinc and vitamin A seems to have a positive impact over the cellular immune system, helping in the treatment of acute and persistent diarrhea [59–61]. It is necessary to prescribe a daily supplementation of zinc at a dose of 10 mg/day for a period of 2–3 months after the diarrhea episode has ceased.
Prophylaxis
In conclusion, UNICEF and WHO propose seven strategic measures to be implemented around the world for diarrheal disease control: (1) fluid replacement to prevent dehydration; (2) zinc treatments, which decrease the severity and duration of the attack; (3) immunization against rotavirus and measles; (4) early and exclusive breastfeeding and vitamin A supplementation; (5) hand washing with soap; (6) improved water supply quantity and quality, including safe storage of water in homes; and (7) promoting community-wide sanitation [16]. Other proposals for reducing the incidence of PD include prolonged and exclusive breastfeeding and strategies to ensure a safe food supply for adequate weight and height development, considering that protein-energy malnutrition is a risk factor for this syndrome [16]. Gut infections lead to malnutrition, and malnutrition increases the risk for further intestinal infections. Ending the vicious cycle of diarrhea–malnutrition should be assigned priority as a goal for pediatricians concerned with the safe development of children [48].
Compliance with Ethics Guidelines
Conflict of Interest Ulysses Fagundes-Neto declares that he has no conflict of interest.
Human and Animal Rights and Informed Consent This article does not contain any studies with human or animal subjects performed by the author.
References
Papers of particular interest, published recently, have been highlighted as:
• Of importance
•• Of major importance
1. Black RE, Cousens S, Johnson HL, et al. Global, regional, andnational causes of child mortality in 2008: a systematic analysis. Lancet. 2010;375:1969–87.
2. Wardlaw T, Salama P, Brocklehurst C, Chopra M, Mason E. Diarrhoea: why children are still dying and what can be done. Lancet. 2010;375:870–2.
3. You D, Wardlaw T, Salama P, Jones G. Levels and trends in under-5 mortality 1990–2008. Lancet. 2010;375:100–03.
4. Das SK, Faruque ASG, Chisti MJ, et al. Changing trend of persistent diarrhea in young children over two decades: observations from a large diarrheal disease hospital in Bangladesh. Acta Paediatr. 2012;101:452–7.
5. Lima AA, Guerrant RL. Persistent diarrhea in children: epidemiology, risk factors, pathophysiology, nutritional impact, and management. Epidemiol Rev. 1992;14:222–42.
6. Victora CG, Huttly SR, Fuchs SC, et al. International differences in clinical patterns of diarrheal deaths: a comparison of children from Brazil, Senegal, Bangladesh and India. J Diarrheal Dis Res. 1993;11:25–9.
7. Galal OM. Persistent diarrhea as an emerging child health problem. Saudi J Gastroenterol. 1997;3:34–40.
8. Fagundes-Neto U, Scaletsky ICA. The gut at war: the consequences of enteropathogenic Escherichia coli infection as a factor of diarrhea and malnutrition. São Paulo Med J. 2000;118:21–9.
9. Matters CD, Bernard C, Iburg KM, Inoue M, Fat DM, Shibuya Ket al. Global burden of disease in 2002: data sources, methods and results. In Global programme on evidence for health policy discussion paper no. 54, (revised 2004). WHO Geneva; 2003:45.
10. Black RE, Morris SS, Bryce J. Where and why are 10 million children dying every year? Lancet. 2003;361:2226–34.
11. Guerrant RL, Oriá RB, Moore SR, Oriá MOB, Lima AAM. Malnutrition as an enteric infectious disease with long-term effects on child development. Nutr Rev. 2008;66:487–505.
12. Petri Jr WA, Miller M, Binder HJ, Levine MM, Dillinghan R, Guerrant RL. Enteric infections, diarrhea, and their impact on function and development. J Clin Invest. 2008;118:1277–90.
13. Moore SR, Lima NL, Soares AM, Oriá RB, Pinkerton RC, Barret LJ, et al. Prolonged Episodes of acute diarrhea reduce growth and Page 5 of 6, 345 increase risk of persistent diarrhea in children. Gatroenterology. 2010;139:1156–64.
14. •• Victora CG. Mortalidade por diarréia: o que o mundo pode aprender com o Brasil? J Pediatr. 2009;85:3–5. This paper reflects the efforts of the Brazilian public health programs to decrease the morbidity and mortality infantile rates due to diarrheal disease.
15. • Maranhão HS, Medeiros MCC, Scaletsky ICA, Fagundes-Neto U, Morais MB. The epidemiological and clinical characteristics and nutritional development of infants with acute diarrhoea, in Northeastern Brazil. Ann Trop Med Parasitol. 2008;102:357–65. This paper reports the prevalence of PD in one of the poorest regions of Brazil and shows the importance of this syndrome as a still very serious public health problem.
16. The United Nations Children's Fund (UNICEF). Countdown to 2015: maternal, newborn and child survival. Tracking progress in maternal, neonatal and child survival: the 2008 report. New York, NY: UNICEF; 2008.
17. Persistent diarrhoea in children in developing countries: Memorandum from a WHO meeting*. Bull of the WHO 1988; 66:709–717
18. Oliveira RP, Sdepanian VL, Barreto JA, Cortez AJP, Carvalho FO,Bordin JO, et al. High prevalence of celiac disease in Brazilian blood donor volunteers based on screening by IgA antitissue transglutaminase antibody. Eur J Gastroenterol Hepatol. 2007;19:43–9.
19. Baqui AH, Sack RB, Black RE, Haider K, Hossain A, Alim ARMA, et al. Enteropathogens associated with acute and persistent diarrhea in Bangladeshi children<5 1992="" age.="" dis.="" infect="" j="" of="" span="" years="">
20. Abba K, Sinfield R, Hart CA, Garner P. Pathogens associated with persistent diarrhea in children in low and middle income countries: systematic review. BMC Infect Dis. 2009;9(88):1–15.
21. Bhutta ZA. Persistent diarrhea in developing countries. Ann Nestlé.2006;64:39–47.
22. Grimwood K, Forbes DA. Acute and Persistent Diarrhea. PediatrClin North America. 2009;56:1343–61.
23. García ALG, Martínez JD, Callejas NP, Herrera VC, Quintero MD. Persistent Diarrhea: bibliographical review. Mediciego. 2006;12:15–20.
24. Fischer WC. L, Ezzati M, Black R E. Global and regional child mortality and burden of disease attributable to zinc deficiency. Eur J Clin Nutr. 2009;63:591–7.
25. Bhutta ZA, Ghishan F, Lindley K, Memon IA, Mittal S, Roads JM. Persistent and chronic diarrhea and malabsorption: Working Group report of the second World Congress of Pediatric Gastroenterology, Hepatology, and Nutrition. J Pediatr Gastroenterol Nutr 39 Suppl 2004; 2:S711.
26. Pawlowski SW, Warren CA, Guerrant R. Diagnosis and Treatment of Acute or Persistent Diarrhea. Gastroenterology. 2009;136:1874–6.
27. Sullivan PB. Studies of the small intestine in persistent diarrhea and malnutrition: The Gambian experience. J Pediatr Gastroenterol Nutr. 2002;34:11–3.
28. Fagundes-Neto U, de Martini-Costa S, Pedroso MZ, Scaletsky IC. Studies of the small bowel surface by scanning electron microscopy in infants with persistent diarrhea. Braz J Med Biol Res. 2000;33:1437– 42.
29. Law D. Adhesion and its role in the virulence of enteropathogenic E.coli. Clin Microbiol Rev. 1994;7:152–73.
30. Okhuysen PC, DuPont HL. Enteroaggregative Escherichia coli (EAEC): A cause of acute and persistent diarrhea of worldwide importance. J Infect Dis. 2010;202:503–5.
31. Hicks S, Candy DCA, Philips AD. Adhesion of Escherichia coli to pediatric intestinal mucosa in vitro. Infect Immun. 1996;64:4751– 60.
32. •• Andrade JAB, Freymüller E, Fagundes-Neto U. Pathophysiology of enteroaggregative Escherichia coli infection: an experimental model utilizing transmission electron microscopy. Arq Gastroenterol. 2010;47:306–12. This paper describes the pathological ultrastructural derangements of the enterocytes due to the enteroaggregative E. coli strains.
33. Nataro JP, Deng Y, Meneval DR, German AL, Martin WC, Levine MM. Aggregative adherence fimbriae I of Enteroaggregative Escherichia coli mediate adherence to HEp-2 cells and hemagglutination of human enterocytes. Infect Immun. 1992;60:2297–304.
34. Tj O. Barletta F, Contreras C, Mercado E. New insights into the epidemiology of enteropathogenic Escherichia coli infection. Trans R Soc Trop Med Hyg. 2008;102:852–6.
35. Chen HD, Frankel G. Enteropathogenic Escherichia coli: unraveling pathogenesis. FEMS Microbiol Rev. 2005;29:83–98.
36. Cantey JR, Blake RK. Diarrhea due to Escherichia coli in the rabbit: a novel mechanism. J Infect Dis. 1977;135:454–62.
37. Moon HW, Whipp SC, Argenzio RA, Levine MM, Gianella RA. Attaching and effacing activities of rabbit and human enteropathogenic Escherichia coli in pig and rabbit intestines. Infect Immun. 1983;41:1340–5.
38. Rothbaum R, MacAdams AJ, Gianella R, Partin JC. A clinicopathologic study of enterocyte-adherent Escherichia coli: a cause of protracted diarrhea in infants. Gastroenterology. 1982;83:441–54.
39. Nataro JP, Kaper JB. Diarrheagenic Escherichia coli. Clin Microbiol Rev. 1998;11:142–201.
40. Fagundes-Neto U, Freymuller E, Gatti MSV, Schmitz LG, ScatetskyI. Enteropathogenic Escherichia coli O111ab:H2 penetrates the small bowel epithelium in an infant with acute diarrhea. Acta Paediatr. 1995;84:453–5.
41. De Boisseau D, Chaussain M, Badoual J, Raymond J, Dupont C. Small bowel bacterial overgrowth in children with chronic diarrhea, abdominal pain or both. J Pediatr. 1996;147:410–1.
42. Lebenthal E, Antonowicz I, Shwachman H. The interrelationship of enterokinase and trypsin activities in intractable diarrhea of infancy, celiac disease, and intravenous alimentation. Pediatr. 1975;56:585– 91.
43. Fagundes Neto U, Viaro T, Wheba J, Machado NL, Patrício FRS, Michalany J. Enteropatia tropical: alterações morfológicas e funcionais do intestino delgado e suas repercussões sobre o estado nutricional. Arq Gastroenterol. 1981;18:177–82.
44. Teichberg S, Fagundes-Neto U, Bayne MA, Lifshtz F. Jejunal macromolecular absorption and bile salt desconjugation in protein-energy malnourished rats. Am J Clin Nutr. 1981;34:1281–91.
45. Jonas A, Avigad S, Diver-Haber A, Katznelson D. Disturbed fat absorption following infectious gastroenteritis in children. J Pediatr. 1979;95:366–72.
46. Rosenberg IH, Solomons NW, Schneider RE. Malabsorption associated with diarrhea and intestinal infections. Am J Clin Nutr. 1977;30:1248–53.
47. Eisenmann A, Amann A, Said M, Datta B, Ledochovsky M. Implementation and interpretation of hydrogen breathe tests. J Breath Res. 2008;2:1–9.
48. Schiller LR. Chronic diarrhea. Curr Treat Options Gastroenterol. 2005;8:259–66.
49. Serra S, Jani PA. An approach to duodenal biopsies. J Clin Pathol. 2006;59:1133–50.
50. Silva JGN, Brito T, Damião AOMC, Laudanna AA, Sipahi AM. Histologic study of colonic mucosa in patients with chronic diarrhea and normal colonoscopic findings. J Clin Gastroenterol. 2006;40:44–8.
51. Lins MGM, Mota MEFA, Silva GAP. Fatores de risco para diarreia persistente em lactentes. Arq Gastroenterol. 2003;40:239–46.
52. Grimwood K, Forbes DA. Acute and Persistent Diarrhea. Pediatr Clin North Am. 2009;56:1343–61.
53. World Health Organization. Handbook IMCI: Integrated Management of Childhood Illness. Geneva: WHO/UNICEF; 2006.http://whqlibdoc.who.int/publications/2005/9241546441.pdf. 54. Amadi B, Mwiya M, Musuku J, Watuka A, Sianong S, Ayoub A, et al. Effect of nitazoxanide on morbidity and mortality in Zambian children with cryptosporidiosis: a randomised controlled trial. Lancet. 2002;360:1375–80.
55. Adagu IS, Nolder D, Warhurst DC, Rossignol JF. In vitro activity of nitazoxanide and related compounds against isolates of Giardia intestinalis, Entamoeba histolytica and Trichomonas vaginalis. J Antimicrob Chemother. 2002;49:103–11.
56. Uauy R, Desjeux JF, Ahmed T, et al. Global efforts to address severe acute malnutrition. JPGN. 2012;55:476–81.
57. Kukuruzovic RH, Brewster DR. Milk formulas in acute gastroenteritis and malnutrition: a randomized trial. J Paediatr Child Helath. 2002;38:571–7.
58. Oliva CAG, Palma D. Suporte nutricional nas diarreias aguda e persistente In: Barbieri D, Palma D. Gastroenterologia e Nutrição, São Paulo: Atheneu; 2001: 259–69.
59. Strand TO, Chandyo RK, Bahl R, Sharma PR, Adhikari RK, Bhandari N, et al. Effectiveness and Efficacy of Zinc for the Treatment of Acute Diarrhea in Young Children. Pediatrics. 2002;109: 898–903.
60. Lukacik M, Thomas RL, Aranda JV. A meta-analysis of the effects of oral zinc in the treatment of acute and persistent diarrhea. Pediatrics. 2008;121:326–36.
61. RobberstadI B, Strand T; Black RE; Sommerfelt H. Costeffectiveness of zinc as adjunct therapy for acute childhood diarrhoea in developing countries. Bull WHO; 82 Geneva July 2004.
In order to establish an accurate diagnosis of the respective etiology and potential complications, detailed information must be obtained on the following topics: a comprehensive clinical history extending as far back as the onset of the diarrheal illness; prior dietary history; breastfeeding history; socioeconomic status and living conditions; and prior medical history, including prior infectious diseases and family history. History and physical examination can provide an outline of the profile of a patient’s nutritional status and other consequences of the diarrheal illness. The laboratory investigation should include a stool culture and a search for ova and parasites in fresh stool specimens, a detection of fecal pH and reducing substances search in the stools, a search for leukocytes and occult blood in the stools, and a determination of fecal α1 anti-trypsin and steatocrit.
Considering the high prevalence of carbohydrate intolerance in the diet reported in PD patients as a perpetuating factor of diarrhea, the approach should include overload tests with the various carbohydrates commonly used in the diet, such as lactose, glucose, and fructose. The lactulose load test should also be carried out in order to detect a possible bacterial overgrowth in the small intestine. All these tests should preferably be carried out by the technique of the H2 breath test, because this is a noninvasive method with high sensitivity and specificity [47].
If possible, the determination of fecal electrolytes should also be done, which will distinguish osmotic from secretory diarrhea [48]. In many cases, a small bowel biopsy should be performed to evaluate the mucosal architecture and the inflammatory infiltrate in the lamina propria, to investigate specific causes, and to demonstrate the extent of intestinal damage [49]. The knowledge of the intensity and extension of morphological damage enables the appropriate dietary management approach. When concurrent rectal bleeding occurs, it may be necessary to perform a rectal biopsy to evaluate the degree and type of inflammation [50].
Management
The importance of proper rehydration and dietary management during the acute diarrheic episode for preventing the progression to PD is well-known [51]. Antibiotic treatment is recommended only for prolonged infection caused by Salmonella, Giardia, Cyclospora, and EAEC (the latter especially if the infant is less than 3 months old or malnourished, immunodeppressed, or shows signs of systemic disease) [52] and in the presence of bloody diarrhea when Shigella is isolated in the stools [53]. The decision to prescribe antibiotics is limited to laboratory evidence of the enteropathogen and type of microbial resistance [54, 55].
Although ready-to-use therapeutic food (RUTF) has greatly improved the capacity for rapid catch-up growth in both the hospital and community, it is necessary to focus more on the initial diets of unwell children with nutritional aggravation, due to the persistence of diarrhea and malabsorption of the nutrients. Fasting is clearly deleterious for such children, as the practice of resuscitation on children’s wards with IV fluids, minerals, vitamins, and antibiotics (without milk or equivalent) has shown. Small, frequent feeding is crucial, but volumes may need to be individualized, which makes it very difficult for pediatric wards with a scarcity of nursing resources, especially during evening and night shifts. WHO guidelines recommend the use of F75 formula, following research done >30 years ago [56]. But now there is a clearer concept of the gut in malnutrition due to the persistence of diarrhea, so better diets are available in the market. Osmolality, in particular, may be important. F75 has an osmolality of 333 mOsmol/L, while there are commercial lactose-free formulas with 160 mOsmol/L [57].
The use of an extensive hydrolyzed protein formula or even a mixture of amino acids based formula is indicated in the following clinical circumstances: (1) acute diarrhea in infants under 6 months or less than 1 year of age with severe malnutrition, associated with dehydration and/or metabolic disorders; (2) PD with aggravation of the nutritional status or frequent recurrence of dehydration and/or metabolic acidosis [58].
The prescription of zinc and vitamin A seems to have a positive impact over the cellular immune system, helping in the treatment of acute and persistent diarrhea [59–61]. It is necessary to prescribe a daily supplementation of zinc at a dose of 10 mg/day for a period of 2–3 months after the diarrhea episode has ceased.
Prophylaxis
In conclusion, UNICEF and WHO propose seven strategic measures to be implemented around the world for diarrheal disease control: (1) fluid replacement to prevent dehydration; (2) zinc treatments, which decrease the severity and duration of the attack; (3) immunization against rotavirus and measles; (4) early and exclusive breastfeeding and vitamin A supplementation; (5) hand washing with soap; (6) improved water supply quantity and quality, including safe storage of water in homes; and (7) promoting community-wide sanitation [16]. Other proposals for reducing the incidence of PD include prolonged and exclusive breastfeeding and strategies to ensure a safe food supply for adequate weight and height development, considering that protein-energy malnutrition is a risk factor for this syndrome [16]. Gut infections lead to malnutrition, and malnutrition increases the risk for further intestinal infections. Ending the vicious cycle of diarrhea–malnutrition should be assigned priority as a goal for pediatricians concerned with the safe development of children [48].
Compliance with Ethics Guidelines
Conflict of Interest Ulysses Fagundes-Neto declares that he has no conflict of interest.
Human and Animal Rights and Informed Consent This article does not contain any studies with human or animal subjects performed by the author.
References
Papers of particular interest, published recently, have been highlighted as:
• Of importance
•• Of major importance
1. Black RE, Cousens S, Johnson HL, et al. Global, regional, andnational causes of child mortality in 2008: a systematic analysis. Lancet. 2010;375:1969–87.
2. Wardlaw T, Salama P, Brocklehurst C, Chopra M, Mason E. Diarrhoea: why children are still dying and what can be done. Lancet. 2010;375:870–2.
3. You D, Wardlaw T, Salama P, Jones G. Levels and trends in under-5 mortality 1990–2008. Lancet. 2010;375:100–03.
4. Das SK, Faruque ASG, Chisti MJ, et al. Changing trend of persistent diarrhea in young children over two decades: observations from a large diarrheal disease hospital in Bangladesh. Acta Paediatr. 2012;101:452–7.
5. Lima AA, Guerrant RL. Persistent diarrhea in children: epidemiology, risk factors, pathophysiology, nutritional impact, and management. Epidemiol Rev. 1992;14:222–42.
6. Victora CG, Huttly SR, Fuchs SC, et al. International differences in clinical patterns of diarrheal deaths: a comparison of children from Brazil, Senegal, Bangladesh and India. J Diarrheal Dis Res. 1993;11:25–9.
7. Galal OM. Persistent diarrhea as an emerging child health problem. Saudi J Gastroenterol. 1997;3:34–40.
8. Fagundes-Neto U, Scaletsky ICA. The gut at war: the consequences of enteropathogenic Escherichia coli infection as a factor of diarrhea and malnutrition. São Paulo Med J. 2000;118:21–9.
9. Matters CD, Bernard C, Iburg KM, Inoue M, Fat DM, Shibuya Ket al. Global burden of disease in 2002: data sources, methods and results. In Global programme on evidence for health policy discussion paper no. 54, (revised 2004). WHO Geneva; 2003:45.
10. Black RE, Morris SS, Bryce J. Where and why are 10 million children dying every year? Lancet. 2003;361:2226–34.
11. Guerrant RL, Oriá RB, Moore SR, Oriá MOB, Lima AAM. Malnutrition as an enteric infectious disease with long-term effects on child development. Nutr Rev. 2008;66:487–505.
12. Petri Jr WA, Miller M, Binder HJ, Levine MM, Dillinghan R, Guerrant RL. Enteric infections, diarrhea, and their impact on function and development. J Clin Invest. 2008;118:1277–90.
13. Moore SR, Lima NL, Soares AM, Oriá RB, Pinkerton RC, Barret LJ, et al. Prolonged Episodes of acute diarrhea reduce growth and Page 5 of 6, 345 increase risk of persistent diarrhea in children. Gatroenterology. 2010;139:1156–64.
14. •• Victora CG. Mortalidade por diarréia: o que o mundo pode aprender com o Brasil? J Pediatr. 2009;85:3–5. This paper reflects the efforts of the Brazilian public health programs to decrease the morbidity and mortality infantile rates due to diarrheal disease.
15. • Maranhão HS, Medeiros MCC, Scaletsky ICA, Fagundes-Neto U, Morais MB. The epidemiological and clinical characteristics and nutritional development of infants with acute diarrhoea, in Northeastern Brazil. Ann Trop Med Parasitol. 2008;102:357–65. This paper reports the prevalence of PD in one of the poorest regions of Brazil and shows the importance of this syndrome as a still very serious public health problem.
16. The United Nations Children's Fund (UNICEF). Countdown to 2015: maternal, newborn and child survival. Tracking progress in maternal, neonatal and child survival: the 2008 report. New York, NY: UNICEF; 2008.
17. Persistent diarrhoea in children in developing countries: Memorandum from a WHO meeting*. Bull of the WHO 1988; 66:709–717
18. Oliveira RP, Sdepanian VL, Barreto JA, Cortez AJP, Carvalho FO,Bordin JO, et al. High prevalence of celiac disease in Brazilian blood donor volunteers based on screening by IgA antitissue transglutaminase antibody. Eur J Gastroenterol Hepatol. 2007;19:43–9.
19. Baqui AH, Sack RB, Black RE, Haider K, Hossain A, Alim ARMA, et al. Enteropathogens associated with acute and persistent diarrhea in Bangladeshi children<5 1992="" age.="" dis.="" infect="" j="" of="" span="" years="">
20. Abba K, Sinfield R, Hart CA, Garner P. Pathogens associated with persistent diarrhea in children in low and middle income countries: systematic review. BMC Infect Dis. 2009;9(88):1–15.
21. Bhutta ZA. Persistent diarrhea in developing countries. Ann Nestlé.2006;64:39–47.
22. Grimwood K, Forbes DA. Acute and Persistent Diarrhea. PediatrClin North America. 2009;56:1343–61.
23. García ALG, Martínez JD, Callejas NP, Herrera VC, Quintero MD. Persistent Diarrhea: bibliographical review. Mediciego. 2006;12:15–20.
24. Fischer WC. L, Ezzati M, Black R E. Global and regional child mortality and burden of disease attributable to zinc deficiency. Eur J Clin Nutr. 2009;63:591–7.
25. Bhutta ZA, Ghishan F, Lindley K, Memon IA, Mittal S, Roads JM. Persistent and chronic diarrhea and malabsorption: Working Group report of the second World Congress of Pediatric Gastroenterology, Hepatology, and Nutrition. J Pediatr Gastroenterol Nutr 39 Suppl 2004; 2:S711.
26. Pawlowski SW, Warren CA, Guerrant R. Diagnosis and Treatment of Acute or Persistent Diarrhea. Gastroenterology. 2009;136:1874–6.
27. Sullivan PB. Studies of the small intestine in persistent diarrhea and malnutrition: The Gambian experience. J Pediatr Gastroenterol Nutr. 2002;34:11–3.
28. Fagundes-Neto U, de Martini-Costa S, Pedroso MZ, Scaletsky IC. Studies of the small bowel surface by scanning electron microscopy in infants with persistent diarrhea. Braz J Med Biol Res. 2000;33:1437– 42.
29. Law D. Adhesion and its role in the virulence of enteropathogenic E.coli. Clin Microbiol Rev. 1994;7:152–73.
30. Okhuysen PC, DuPont HL. Enteroaggregative Escherichia coli (EAEC): A cause of acute and persistent diarrhea of worldwide importance. J Infect Dis. 2010;202:503–5.
31. Hicks S, Candy DCA, Philips AD. Adhesion of Escherichia coli to pediatric intestinal mucosa in vitro. Infect Immun. 1996;64:4751– 60.
32. •• Andrade JAB, Freymüller E, Fagundes-Neto U. Pathophysiology of enteroaggregative Escherichia coli infection: an experimental model utilizing transmission electron microscopy. Arq Gastroenterol. 2010;47:306–12. This paper describes the pathological ultrastructural derangements of the enterocytes due to the enteroaggregative E. coli strains.
33. Nataro JP, Deng Y, Meneval DR, German AL, Martin WC, Levine MM. Aggregative adherence fimbriae I of Enteroaggregative Escherichia coli mediate adherence to HEp-2 cells and hemagglutination of human enterocytes. Infect Immun. 1992;60:2297–304.
34. Tj O. Barletta F, Contreras C, Mercado E. New insights into the epidemiology of enteropathogenic Escherichia coli infection. Trans R Soc Trop Med Hyg. 2008;102:852–6.
35. Chen HD, Frankel G. Enteropathogenic Escherichia coli: unraveling pathogenesis. FEMS Microbiol Rev. 2005;29:83–98.
36. Cantey JR, Blake RK. Diarrhea due to Escherichia coli in the rabbit: a novel mechanism. J Infect Dis. 1977;135:454–62.
37. Moon HW, Whipp SC, Argenzio RA, Levine MM, Gianella RA. Attaching and effacing activities of rabbit and human enteropathogenic Escherichia coli in pig and rabbit intestines. Infect Immun. 1983;41:1340–5.
38. Rothbaum R, MacAdams AJ, Gianella R, Partin JC. A clinicopathologic study of enterocyte-adherent Escherichia coli: a cause of protracted diarrhea in infants. Gastroenterology. 1982;83:441–54.
39. Nataro JP, Kaper JB. Diarrheagenic Escherichia coli. Clin Microbiol Rev. 1998;11:142–201.
40. Fagundes-Neto U, Freymuller E, Gatti MSV, Schmitz LG, ScatetskyI. Enteropathogenic Escherichia coli O111ab:H2 penetrates the small bowel epithelium in an infant with acute diarrhea. Acta Paediatr. 1995;84:453–5.
41. De Boisseau D, Chaussain M, Badoual J, Raymond J, Dupont C. Small bowel bacterial overgrowth in children with chronic diarrhea, abdominal pain or both. J Pediatr. 1996;147:410–1.
42. Lebenthal E, Antonowicz I, Shwachman H. The interrelationship of enterokinase and trypsin activities in intractable diarrhea of infancy, celiac disease, and intravenous alimentation. Pediatr. 1975;56:585– 91.
43. Fagundes Neto U, Viaro T, Wheba J, Machado NL, Patrício FRS, Michalany J. Enteropatia tropical: alterações morfológicas e funcionais do intestino delgado e suas repercussões sobre o estado nutricional. Arq Gastroenterol. 1981;18:177–82.
44. Teichberg S, Fagundes-Neto U, Bayne MA, Lifshtz F. Jejunal macromolecular absorption and bile salt desconjugation in protein-energy malnourished rats. Am J Clin Nutr. 1981;34:1281–91.
45. Jonas A, Avigad S, Diver-Haber A, Katznelson D. Disturbed fat absorption following infectious gastroenteritis in children. J Pediatr. 1979;95:366–72.
46. Rosenberg IH, Solomons NW, Schneider RE. Malabsorption associated with diarrhea and intestinal infections. Am J Clin Nutr. 1977;30:1248–53.
47. Eisenmann A, Amann A, Said M, Datta B, Ledochovsky M. Implementation and interpretation of hydrogen breathe tests. J Breath Res. 2008;2:1–9.
48. Schiller LR. Chronic diarrhea. Curr Treat Options Gastroenterol. 2005;8:259–66.
49. Serra S, Jani PA. An approach to duodenal biopsies. J Clin Pathol. 2006;59:1133–50.
50. Silva JGN, Brito T, Damião AOMC, Laudanna AA, Sipahi AM. Histologic study of colonic mucosa in patients with chronic diarrhea and normal colonoscopic findings. J Clin Gastroenterol. 2006;40:44–8.
51. Lins MGM, Mota MEFA, Silva GAP. Fatores de risco para diarreia persistente em lactentes. Arq Gastroenterol. 2003;40:239–46.
52. Grimwood K, Forbes DA. Acute and Persistent Diarrhea. Pediatr Clin North Am. 2009;56:1343–61.
53. World Health Organization. Handbook IMCI: Integrated Management of Childhood Illness. Geneva: WHO/UNICEF; 2006.http://whqlibdoc.who.int/publications/2005/9241546441.pdf. 54. Amadi B, Mwiya M, Musuku J, Watuka A, Sianong S, Ayoub A, et al. Effect of nitazoxanide on morbidity and mortality in Zambian children with cryptosporidiosis: a randomised controlled trial. Lancet. 2002;360:1375–80.
55. Adagu IS, Nolder D, Warhurst DC, Rossignol JF. In vitro activity of nitazoxanide and related compounds against isolates of Giardia intestinalis, Entamoeba histolytica and Trichomonas vaginalis. J Antimicrob Chemother. 2002;49:103–11.
56. Uauy R, Desjeux JF, Ahmed T, et al. Global efforts to address severe acute malnutrition. JPGN. 2012;55:476–81.
57. Kukuruzovic RH, Brewster DR. Milk formulas in acute gastroenteritis and malnutrition: a randomized trial. J Paediatr Child Helath. 2002;38:571–7.
58. Oliva CAG, Palma D. Suporte nutricional nas diarreias aguda e persistente In: Barbieri D, Palma D. Gastroenterologia e Nutrição, São Paulo: Atheneu; 2001: 259–69.
59. Strand TO, Chandyo RK, Bahl R, Sharma PR, Adhikari RK, Bhandari N, et al. Effectiveness and Efficacy of Zinc for the Treatment of Acute Diarrhea in Young Children. Pediatrics. 2002;109: 898–903.
60. Lukacik M, Thomas RL, Aranda JV. A meta-analysis of the effects of oral zinc in the treatment of acute and persistent diarrhea. Pediatrics. 2008;121:326–36.
61. RobberstadI B, Strand T; Black RE; Sommerfelt H. Costeffectiveness of zinc as adjunct therapy for acute childhood diarrhoea in developing countries. Bull WHO; 82 Geneva July 2004.
 FIgura 1- A triste realidade do resultado final da doença diarréica nos bolsões de miséria que ainda existem no nosso país e nos demais países em desenvolvimento.
FIgura 1- A triste realidade do resultado final da doença diarréica nos bolsões de miséria que ainda existem no nosso país e nos demais países em desenvolvimento.
 Figura 3- Microfotografia em maior aumento do material de biópsia do intestino delgado do paciente mostrando a presença de nichos bacterianos firmemente aderidos à superfície epitelial com transformação cuboidal dos enterócitos. Na lâmina própria, logo abaixo da membrana basal nota-se um infiltrado hemorrágico.
Figura 3- Microfotografia em maior aumento do material de biópsia do intestino delgado do paciente mostrando a presença de nichos bacterianos firmemente aderidos à superfície epitelial com transformação cuboidal dos enterócitos. Na lâmina própria, logo abaixo da membrana basal nota-se um infiltrado hemorrágico. Figura 4- Microfotografia em imersão do material de biópsia do intestino delgado do paciente evidenciando nichos bacterianos firmemente aderidos à superfície dos enterócitos, os quais se acham intensamente alterados quanto a sua morfologia.
Figura 4- Microfotografia em imersão do material de biópsia do intestino delgado do paciente evidenciando nichos bacterianos firmemente aderidos à superfície dos enterócitos, os quais se acham intensamente alterados quanto a sua morfologia. Figura 5- Microfotografia em imersão do material de biópsia do intestino delgado do paciente evidenciando arrancamento dos enterócitos que se acham totalmente distorcidos e a presença de nichos bacterianos em sua superfície.
Figura 5- Microfotografia em imersão do material de biópsia do intestino delgado do paciente evidenciando arrancamento dos enterócitos que se acham totalmente distorcidos e a presença de nichos bacterianos em sua superfície.
 Figura 7- Vide legenda acima.
Figura 7- Vide legenda acima. Figura 8- Nichos bacterianos de Escherichia coli O 119 firmemente aderidos à superfície dos enterócitos. Nota-se a mesma anormalidade descrita em nossso paciente.
Figura 8- Nichos bacterianos de Escherichia coli O 119 firmemente aderidos à superfície dos enterócitos. Nota-se a mesma anormalidade descrita em nossso paciente. Figura 9- Ultramicrofotgrafia do material de biópsia do intestino delgado evidenciando destruição das microvilosidades e a formação da lesão em pedestal pela bactéria.
Figura 9- Ultramicrofotgrafia do material de biópsia do intestino delgado evidenciando destruição das microvilosidades e a formação da lesão em pedestal pela bactéria. Figura 10- Vide legenda acima.
Figura 10- Vide legenda acima.
 Figura 12- Ultramicrofotografia do material de biópsia do intestino delgado de um paciente nosso portador de DP evidenciando as microvilosidades tendendo a formar tufos (setas); no interior do citoplasma observam-se retículos endoplasmáticos preservados (er), bem como as mitocôndrias e inúmeros corpos multivesiculares (mvb).
Figura 12- Ultramicrofotografia do material de biópsia do intestino delgado de um paciente nosso portador de DP evidenciando as microvilosidades tendendo a formar tufos (setas); no interior do citoplasma observam-se retículos endoplasmáticos preservados (er), bem como as mitocôndrias e inúmeros corpos multivesiculares (mvb).
 Figura 14- Nosso paciente A lutando pela sobrevivência durante o período de estado da doença sendo monitorado em suas funções vitais.
Figura 14- Nosso paciente A lutando pela sobrevivência durante o período de estado da doença sendo monitorado em suas funções vitais.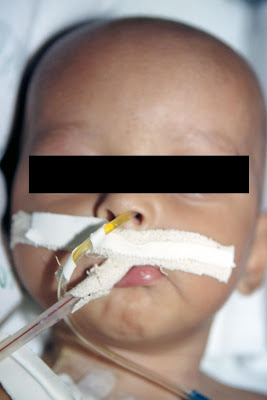 Figura 15- Nosso paciente A recebendo a atenção médica na UCI ainda em estado crítico de saúde.
Figura 15- Nosso paciente A recebendo a atenção médica na UCI ainda em estado crítico de saúde.
 Figura 2- Capa da revista Time alertando para os riscos de morte causados pela infecção pelas cepas de Escherichia coli enterohemorrágica em especial a O157:H7.
Figura 2- Capa da revista Time alertando para os riscos de morte causados pela infecção pelas cepas de Escherichia coli enterohemorrágica em especial a O157:H7. Figura 3- Diagrama esquemático do processo evolutivo das perdas hidro-eletrolíticas durante uma infecção entérica que caso não sejam devidamente corrigidas leva ao quadro de desidratação abaixo demonstrado.
Figura 3- Diagrama esquemático do processo evolutivo das perdas hidro-eletrolíticas durante uma infecção entérica que caso não sejam devidamente corrigidas leva ao quadro de desidratação abaixo demonstrado. Figura 4- Desenho esquemático da terra ressequida e fotografia montada de uma criança desidratada por diarréia grave. Notar o turgor pastoso do tecido celular subcutâneo, os olhos encovados e a mucosa oral sêca.
Figura 4- Desenho esquemático da terra ressequida e fotografia montada de uma criança desidratada por diarréia grave. Notar o turgor pastoso do tecido celular subcutâneo, os olhos encovados e a mucosa oral sêca.



 Figura 9- Minha foto tirada da porta de entrada da Unidade Metabólica que homenageou meu querido e saudoso mestre Horácio Toccalino.
Figura 9- Minha foto tirada da porta de entrada da Unidade Metabólica que homenageou meu querido e saudoso mestre Horácio Toccalino. Figura 10- Nosso pessoal da enfermagem devidamente treinado e capacitado para cuidar dos pacientes internados na Unidade Metabólica.
Figura 10- Nosso pessoal da enfermagem devidamente treinado e capacitado para cuidar dos pacientes internados na Unidade Metabólica. Figura 11- Paciente portador de diarréia sendo submetido à balanço metabólico com a coleta de urina separada das fezes para se poder ter um cálculo preciso das perdas fecais e de urina, o que muito contribui para o cálculo exato da reposição hidro-eletrolítica. A utilização rotineira desta técnica possibilita uma significativa diminuição do tempo de internação e ao mesmo tempo reduz tremendamente as taxas de mortalidade intra-hospitalar.
Figura 11- Paciente portador de diarréia sendo submetido à balanço metabólico com a coleta de urina separada das fezes para se poder ter um cálculo preciso das perdas fecais e de urina, o que muito contribui para o cálculo exato da reposição hidro-eletrolítica. A utilização rotineira desta técnica possibilita uma significativa diminuição do tempo de internação e ao mesmo tempo reduz tremendamente as taxas de mortalidade intra-hospitalar.

























