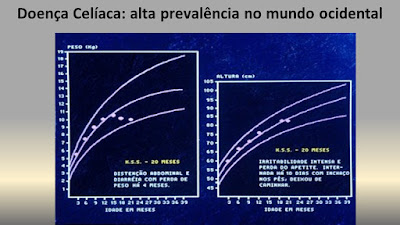
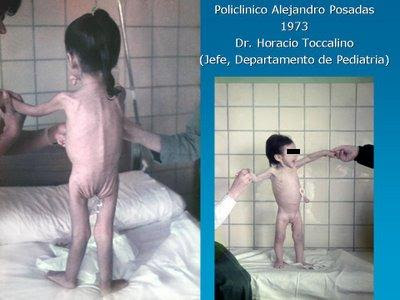
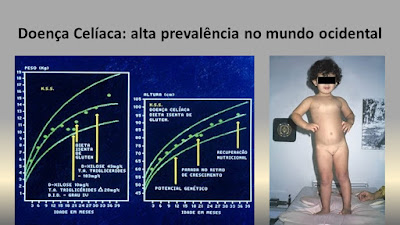
Aquellos criterios diagnósticos fueron aceptados
unánimemente por la comunidad científica internacional, y sirvieron de guía
protocolizada para el correcto diagnóstico de niños bajo sospecha de ser
celíacos, y precisaban la realización de al menos tres biopsias intestinales
secuenciales hasta completar el diagnóstico final de EC.
Esta estricta metodología diagnóstica, basada en la
práctica de repetidas biopsias de intestino delgado fue mantenida hasta que la
propia Sociedad Europea de Gastroenterología, Hepatología y Nutrición
Pediátrica (ESPGHAN) la modificó veinte años más tarde, gracias al advenimiento
de los marcadores serológicos, proponiendo una reducción en el número de
biopsias. El diagnóstico se confirmaba con la demostración de lesión de la
mucosa intestinal, mientras el paciente consumía dieta con gluten, con una
primera biopsia, y requiriendo sólo una segunda biopsia en casos muy concretos:
pacientes asintomáticos al diagnóstico, o con primera biopsia no definitoria, o
en los que la primera biopsia se había realizado antes de los 2 años de edad.
Pero a lo largo de los últimos años, se han venido
produciendo decisivos avances en el conocimiento de los aspectos clínicos,
inmunológicos y genéticos de la EC, conociéndose cada vez mejor las distintas
formas clínicas de expresión de la misma (el llamado “iceberg celíaco”), y sus
manifestaciones digestivas y extradigestivas, con formas activas, silentes,
latentes y potenciales. La parte oculta de este “iceberg celíaco” es cada vez
más evidente, y en los últimos 20 años conocemos mejor este importante aspecto
de la EC (Figuras 15-16-17-18):
Figura 15- Anticorpos anti-gliadina.
Figura 16- Anticorpo anti-endomíseo.
Figura 17- Anticorpo anti-transglutaminase.
Figura 18- Anticorpo
anti-gliadina deaminada.
-
El
amplio espectro clínico de presentación, sabiéndose en la actualidad que la EC
es una enfermedad multisistémica, y no localizada exclusivamente en el
intestino delgado
-
Las
enfermedades asociadas y los distintos grupos de riesgo relacionados con la EC
La etiopatogenia e inmunogenética de la EC:
evidencia de genes de susceptibilidad HLA DQ2/DQ8 relacionados con la EC,
descubrimiento de la transglutaminasa tisular como el autoantígeno de la EC y
desarrollo de marcadores serológicos de actividad altamente sensibles y
específicos para el diagnóstico de la EC (anticuerpos antigliadina como primeros
marcadores, y posteriormente, anticuerpos antiendomisio, anticuerpos
antitransglutaminasa y anticuerpos antigliadina deaminados).
Paralelamente al avance en la investigación en
estos aspectos clínicos y de laboratorio de la EC, también se ha demostrado el
cambiante espectro histológico de las lesiones intestinales de los pacientes
celíacos en actividad, habiéndose demostrado que no es necesaria la existencia
de una lesión severa de las vellosidades intestinales para el diagnóstico, y
hoy en día sabemos que la EC en actividad puede presentar lesiones de bajo
grado (Figura 19).
Figura 19- Progressão sequencial
da lesão da mucosa duodenal na Doença Celíaca.
Marcadores serológicos
Los marcadores serológicos son
herramientas muy útiles, tanto para el diagnóstico como para el seguimiento de
la EC.
La determinación de anticuerpos
antigliadina (AGA) de clases IgA e IgG fue la primera prueba serológica
que se utilizó en el diagnóstico de la EC a comienzos de los años 70 del siglo
pasado. Sin embargo, los AGA aunque tienen buena sensibilidad, se detectan con
frecuencia en personas sanas o en otros trastornos digestivos no celíacos, por
lo que su uso está actualmente desautorizado por la Federación de Sociedades de
Gastroenterología, Hepatología y Nutrición Pediátrica (FISPGHAN), y en estudios
posteriores se ha demostrado que la utilización de estos anticuerpos en niños
mayores de 2 años no es útil (Figuras 20-21-22).
Figura 20- Sensibilidade e
especificidade do anticorpo anti-gliadina.
Los anticuerpos antiendomisio
(EMA) comenzaron a utilizarse en los años 80, y tienen una sensibilidad y
especificidad muy altas en el diagnóstico de la EC. Se determinan por
inmunofluorescencia indirecta (IFI) con una técnica cualitativa o
semicuantitativa, con diluciones progresivas del suero, y lectura en
microscopio de fluorescencia, que requiere alta cualificación de personal.
Figura 21- Sensibilidade e
especificidade do anticorpo anti-endomíseo.
Los anticuerpos antitransglutaminasa
tisular (ATGt) se determinan utilizando técnicas automatizadas de
inmunoanálisis cuantitativo (ELISA), con una especificidad y sensibilidad del
95%.
Figura 22- Sensibilidad e
especificidade do anticorpo anti-transglutaminase.
Los anticuerpos antigliadina
deaminados (AGAdp) son los últimos marcadores introducidos en el
diagnóstico de la EC, utilizando como antígeno los péptidos de gliadina
modificados, y surgen a raíz de la investigación para mejorar la eficiencia de
los AGA nativos.
En la actualidad, la oferta de
testes comerciales para la determinación de estos marcadores serológicos de
actividad de EC es muy amplia, tanto por el anticuerpo analizado (AGA, EMA,
ATGt, AGAdp, mixtos ATGt/AGAdp) como por el isotipo de cada anticuerpo (IgA,
IgG, polivalente IgA/IgG), como por la tecnología utilizada (IFI, ELISA,
fluoroenzimoinmunoensayo, quimioluminiscencia), por lo que la elección del test
debe basarse en las recomendaciones internacionales y en los datos basados en
la evidencia científica. Cada laboratorio debe utilizar el test más eficaz en
función del contexto asistencial en el que se encuentre.
Los anticuerpos ATGt y/o
anticuerpos EMA de clase IgA (o de clase IgG si existe déficit de IgA) son en
la actualidad los marcadores de elección para el diagnóstico de EC, según las
últimas recomendaciones de la ESPGHAN. Los
anticuerpos AGAdp de clase IgG son de gran utilidad en niños menores de 2 años,
en niños con déficit de IgA, o cuando los ATGt son negativos.
Es importante resaltar que el
laboratorio debe ofrecer garantías de:
-
Participación
en programas de control de calidad interno y externo.
-
Utilizar
testes validados, y con valores de corte (“cut-off”)
bien establecidos por el fabricante para cada grupo de edad.
-
Expresar
los resultados con cifras numéricas, indicando la clase de inmunoglobuilina
(IgA o IgG), no siendo suficiente con la información de “positivo” o
“negativo”.
-
Los
informes de EMA deben indicar también la clase de Ig y la dilución sérica
final, presentando el resultado como negativo o positivo acompañado de la
dilución
Aunque se han desarrollado
testes rápidos para el diagnóstico de EC, mediante técnicas de
inmunocromatografía, conocidos como test de punto de contacto (POC), con
determinación de anticuerpos ATGt y anticuerpos AGA en una gota de sangre, y
que podrían ser utilizados en programas de cribado o en una primera
aproximación diagnóstica a la EC en pacientes sintomáticos, en el momento
actual este tipo de test sólo debe utilizarse con fines de investigación, y no
pueden sustituir a las técnicas utilizadas en el laboratorio.
Marcadores genéticos
La EC está fuertemente ligada
con los genes HLA DQ2 y HLA DQ8, de forma que más del 90% de los pacientes
celíacos muestran una variante del heterodímero HLA DQ2, y el resto suelen
presentar un segundo heterodímero de riesgo, HLA DQ8. La presencia de estos
marcadores genéticos de susceptibilidad en la población general no implica
necesariamente que ese individuo vaya a desarrollar la EC. Varios estudios
demostraron que cerca del 30% a 40% de la población tiene estos heterodimeros y
no presenta EC. Su determinación tiene un valor predictivo negativo cercano al
100%, de modo que su ausencia permite descartar casi con total seguridad el
desarrollo de la enfermedad (Figuras 23-24-25).
Figura 23- Complexo
genético HLA DQ2/DQ8.
Figura 24- Complexo genético HLA DQ2/DQ8.
Figura 25- Complexo genético HLA DQ2/DQ8.
Hay que tener en cuenta que,
en determinadas poblaciones latinoamericanas, con diagnóstico de EC, no se han
encontrado haplotipos HLA DQ2 ni DQ8, como sucede en una serie de pacientes
celíacos de Chile, Argentina y Uruguay estudiados por Araya y cols, que eran
DQ2/DQ8 negativos.
CONCLUSIONES
La confirmación diagnóstica de
la Enfermedad Celíaca (EC) requiere una combinación de distintas variables:
manifestaciones clínicas, anticuerpos específicos, haplotipo HLA DQ2 y/o DQ8 y
enteropatía. De acuerdo a las últimas evidencias, el patrón oro para el
diagnóstico de la EC no está exclusivamente determinado por los resultados de
la biopsia intestinal.
Los marcadores serológicos
constituyen la primera herramienta en el algoritmo diagnóstico. Los anticuerpos
ATGt, EMA, y AGAdp IgG en niños menores de 2 años o niños con déficit de IgA,
son los de mayor sensibilidad y especificidad.
Para que los marcadores
serológicos tengan peso suficiente en el diagnóstico y sean efectivamente
útiles deben cumplir con los siguientes requisitos:
u Realizarse en laboratorios con control de calidad
interno y externo.
u Los testes deben ser validados con valores de
cortes bien establecidos.
u ATGt y AGAdp: indicar de qué clase son (IgA/IgG) y
expresados en cifras.
u EMA: indicar de qué clase son (IgA/IgG) y expresar
dilución.
La tipificación del HLA para
el diagnóstico de EC tiene un alto valor predictivo negativo, cercano al 100%.
Su ausencia hace muy poco probable la ocurrencia de EC.
Los individuos asintomáticos
pertenecientes a grupos de riesgo siempre deben diagnosticarse con biopsia
duodenal confirmatoria.