Prof. Dr. Ulysses Fagundes Neto
A renomada revista JPGN publicou um artigo de revisão, em fevereiro de 2024, intitulado “Longitudinal screening of HLA-nonrisk children for celiac disease to age 15 years: CiPiS study”, de Michaela Boström e cols., que abaixo passo a resumir em seus principais aspectos.
- Introdução
A Doença Celíaca (DC) é assintomática em cerca de metade dos casos, porém, a abordagem diagnóstica pode ser um método de busca ativa, através do rastreamento de certos grupos de risco. O retardamento do diagnóstico é frequente, e, consequentemente são perdidos vários anos de tratamento pela dieta restrita isenta de glúten, o que pode acarretar complicações tais como, deficiência de ferro, osteopenia e osteoporose, e problemas da saúde mental. A prevalência global é aproximadamente de 1%, e maiores prevalências podem inclusive ser observadas, como na Suécia e na Finlândia. Existem testes disponíveis e largamente aceitos como marcadores para a DC, dos quais, o anticorpo anti-transglutaminase que apresenta uma performance diagnóstica média de 92,8% de sensibilidade 97,9% de especificidade, é atualmente o teste mais comumente utilizado no rastreamento da DC. Rastreamentos populacionais para a DC têm sido demandados, mas, parece haver uma necessidade para pesquisas mais aprofundadas para alcançar alguns dos critérios de rastreamento propostos pela OMS.
A coorte de nascimento no sul da Suécia (Skane) para DC, foi iniciada para avaliar a presunção de rastreamento para DC, e examinou crianças nascidas entre 2001 e 2004, nas idades de 3, 9 e 15 anos, respectivamente, comparando as crianças portadoras dos antígenos leucocitários humanos (HLA) dos haplotipos DQ2 e DQ8 ou ambos, com crianças que não eram portadoras desses haplotipos de risco. Nós relatamos previamente o desfecho do rastreamento nas idades de 3 e 9 anos. Aos 3 anos de idade, 3,4% das crianças portadoras de haplotipos de HLA de risco foram diagnosticadas com DC em comparação com nenhuma das crianças HLA sem risco. Aos 9 anos de idade, 3,8% das crianças portadoras de HLA de risco, foram diagnosticadas com DC, comparadas com nenhuma criança portadora de HLA sem risco. Dentre aquelas crianças previamente rastreadas aos 3 anos de idade, 3,1% foram diagnosticadas com DC aos 9 anos de idade, comparados com 4,5% daquelas que nunca haviam sido rastreadas pelo teste aos 9 anos, o que indica que, o rastreamento nestas idades deve ser repetido, mas, podem ser restritos às crianças portadoras de HLA de risco. No presente estudo, são relatados os resultados do rastreamento nesta coorte aos 15 anos de idade.
- Material e Métodos
Skane é uma província do sul da Suécia que em 2004 possuía 1.2 milhão de habitantes, e, no período do registro entre junho 2001 a agosto de 2004, cerca de 39 mil crianças haviam nascido. Aos 5 anos de idade entre fevereiro de 2016 e fevereiro de 2020, 12.948 (99,4%) crianças foram convidadas para um novo rastreamento.
- Resultados
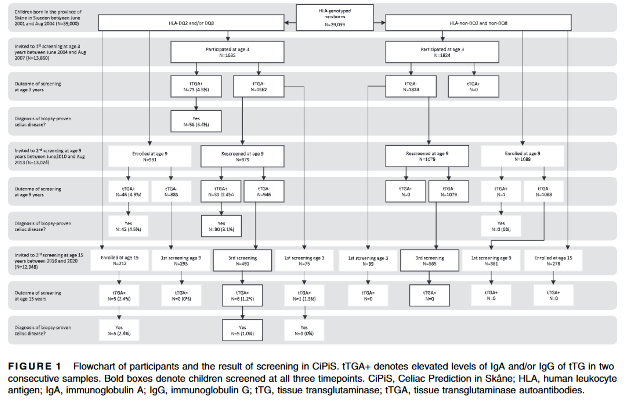
Um total de 5.969 (43,1% das 13.860 crianças convidadas) foram rastreadas pelo menos 1 vez pelo anticorpo anti-transglutaminase IgA e IgG. Neste grupo, 2.904 (48,7% eram meninas) e 2.778 (46,5% eram meninos) que pertenciam ao grupo HLA com risco. O número de crianças rastreadas nos diferentes momentos do estudo, está descrito na Figura 1.
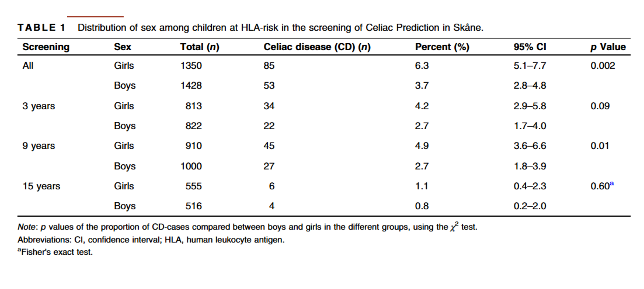
Ao todo, houve uma maioria de meninas em relação aos meninos diagnosticados com DC, porém, não houve diferença por sexo no rastreamento aos 3 ou aos 15 anos de idade (Tabela 1).
Dentre as crianças do grupo HLA de risco, que foram rastreadas aos 15 anos de idade, 14/1.071 (1,3%) foram inicialmente positivos para IgA ou IgG ou para ambos dos quais, 12/1.071 (1,1%) permaneceram persistentemente positivos em 2 amostras coletadas consecutivamente em comparação com 0/3.303 crianças HLA sem risco.
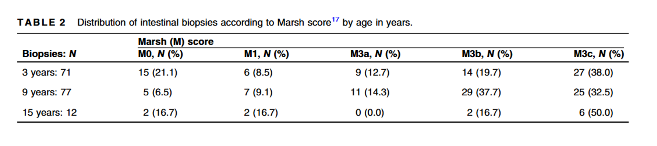
Todas as 12 crianças IgA positivas, foram submetidas à EDA com biópsias e dentre elas, 10/1.071 (0,9%) foram diagnosticadas com DC e nas 2 remanescentes a biópsia revelou-se normal (Tabela 2).
Dentre as 12 crianças rastreadas com IgA positivo aos 15 anos, 6 (50%) tinham sido rastreadas aos 3 e aos 9 anos de idade, dentre as quais 1 havia apresentado valores elevados de IgA no rastreamento aos 9 anos de idade. Uma dessas crianças que também havia participado do estudo aos 3 anos de idade, apresentava IgA não-elevada, e 55 delas haviam participado pela primeira vez (Figura 1).
O valor preditivo positivo para a persistência da positividade da IgA nas idades 3, 9 e 15 anos foram 78,9%, 93,5% e 83,3%, respectivamente (Tabela 2).
- Discussão
O presente estudo foi o primeira que seguiu longitudinalmente uma coorte do nascimento aos 15 anos de idade, e que rastreou tanto as crianças portadoras de HLA com risco como crianças HLA sem risco para DC, em tempos regularmente propostos aos 3, 9 e 15 anos de idade. Foi observada uma predominância de meninas diagnosticadas com DC em todas as idades, o que está de acordo com outros rastreamentos populacionais, e, uma meta análise prévia demonstra um risco aumentado de 1,5x nas mulheres sobre os homens para desenvolver DC.
Este estudo, também teve um achado de grande importância, posto que nenhuma das crianças que apresentavam HLA sem risco, desenvolveu DC em todos os momentos do rastreamento. Este fato, endossa que o valor preditivo negativo do HLA DQ2/DQ8, apoiando a proposta de que o rastreamento deve ser restrito somente às populações portadoras de HLA com risco de DC.
Outro achado de relevância foi que novos casos foram detectados em todas as idades nas crianças portadoras de HLA com risco. Embora a incidência de novos casos de DC tenha declinado depois dos 9 anos, fica demonstrado que o rastreamento deve ser realizado em múltiplos momentos de tempo, para também detectar casos com início da DC em idades maiores.
- Conclusões
Este estudo conclui que o rastreamento da população pediátrica em geral para DC aos 15 anos de idade detecta novos casos, mesmo naquelas crianças previamente rastreadas, e, que o rastreamento necessita ser repetido, mas deve ser limitado aos indivíduos que são portadores de HLA com risco (DQ2/DQ8).
- Referências Bibliográficas
- Boström, M. e cols. – JPGN, 2024;78:1143-1148.
- Husby S. e cols – JPGN, 2020;70:141-156
- Andren AC. e cols.-JAMA, 2019;322:514-523
- Meijer CR. e cols. – Gastroenterology 2022;163:426-436