A Organização Mundial da Saúde, em um relatório publicado em 2009, estima que morrem anualmente cerca de 9.000.000 de crianças, com menos de 5 anos de idade, a cada ano em todo o nosso universo. A doença diarréica é a segunda causa mais importante de morte com 16%, logo a seguir da pneumonia com 17% das mortes, excluindo as diversas causas neonatais que são responsáveis por 37% delas. A pergunta que se impõe é por que uma enfermidade de fácil prevenção causa a morte de cerca de 1.500.000 de crianças menores de 5 anos de idade? A redução destes índices de mortalidade depende, por um lado, da intervenção terapêutica tornando universal a distribuição da solução de reidratação oral de baixa osmolaridade e da prescrição de Zinco. Por outro lado, medidas preventivas também são necessárias serem implementadas as quais serão posteriormente abordadas.
Do ponto de vista do manejo terapêutico está bem estabelecida a importância da reidratação oral (considerada um dos maiores avanços terapêuticos da Medicina do século XX) e da conduta dietética adequada na fase aguda da diarréia para evitar seu prolongamento. É importante ressaltar que a suspensão prolongada da dieta contribui diretamente para o agravamento do estado nutricional, pois dificulta o reparo da mucosa intestinal, enquanto que o uso abusivo e indiscriminado de antimicrobianos altera a microbiota, o que vem a contribuir para a persistência da diarréia, e, portanto, agravando a evolução do episódio.
Na nossa experiência clínica, consolidada no atendimento de crianças portadoras de DP na Unidade Metabólica "Horácio Toccalino" do Hospital Umberto I, durante toda uma década, nos anos 1980 e 1990, passamos a definir como fatores de risco para má evolução do processo diarréico, a ocorrência em lactentes menores de seis meses de idade ou menores de um ano com desnutrição grave, a presença de desidratação e/ou distúrbios metabólicos, o prolongamento do quadro diarréico com importante agravo do estado nutricional ou freqüentes recidivas de desidratação e/ou acidose (Figuras 1 & 2).
 Figura 1- Nosso paciente A no momento da internação recebendo o tratamento do choque hipovolêmico e da acidose metabólica tendo seus sinais vitais devidamente monitorados.
Figura 1- Nosso paciente A no momento da internação recebendo o tratamento do choque hipovolêmico e da acidose metabólica tendo seus sinais vitais devidamente monitorados. Figura 2- Nosso paciente A em íleo paralítico devido aos distúrbios metabólicos em respiração assistida e recebendo nutrição parenteral por via periférica.
Figura 2- Nosso paciente A em íleo paralítico devido aos distúrbios metabólicos em respiração assistida e recebendo nutrição parenteral por via periférica. Figura 3- Nosso paciente A já fora do risco de morte e recebendo dieta por via oral á base de hidrolisado protéico, porém ainda com evacuações semi-pastosas mas em franca recuperação clínica e nutricional.
Figura 3- Nosso paciente A já fora do risco de morte e recebendo dieta por via oral á base de hidrolisado protéico, porém ainda com evacuações semi-pastosas mas em franca recuperação clínica e nutricional.Diante da gravidade da diarréia, a qual ainda é considerada um importante problema de saúde pública, e que depende da integridade do sistema imunológico para ser solucionada, Rocha e cols., em 2009 (The Electronic J Ped Gastroenterol Nutr), em estudo de metanálise, confirmaram o importante impacto positivo da prescrição de Zinco e da vitamina A sobre a imunidade celular, auxiliando no tratamento da diarréia aguda e persistente. Os autores concluíram que a prescrição de Zinco é não somente essencial como elemento curativo dos episódios de diarréia mas também desempenha especial papel de caráter preventivo contra esta patologia. Para alcançar este objetivo, é necessário que se faça a suplementação diária de Zinco, à dose de 10 mg/dia, por um período de 2 a 3 meses após cessar o episódio de diarréia, e a ingestão permanentemente adequada de fontes alimentares para que seja possível atingir as recomendações de ingestão diária deste micronutriente. Lucacik e cols., em 2008 (Pediatr 121:326-36), comprovaram a eficácia desta conduta no manejo da DP e sugerem que este efeito ocorre pelo aumento da reabsorção de água e eletrólitos pelo intestino e pelo aumento da capacidade de regeneração do epitélio intestinal. Níveis aumentados das dissacaridases na bordadura em escova dos enterócitos indicam um efeito transportador para este eletrólito e uma forte resposta imune auxiliando na defesa intestinal, a qual também tem sido descrita quando o Zinco encontra-se em níveis plasmáticos adequados (Figuras 4 -5 - 6 & 7).
 Figura 4- Nosso paciente A totalmente recuperado clínica e nutricionalmente.
Figura 4- Nosso paciente A totalmente recuperado clínica e nutricionalmente. Figura 5- Nosso paciente A em vias de receber alta hospitalar totalmente curado.
Figura 5- Nosso paciente A em vias de receber alta hospitalar totalmente curado.Com relação aos antimicrobianos em pacientes com DP, em algumas circunstâncias existem evidências que seu uso pode diminuir o tempo de duração dos sintomas e em alguns casos diminuir a probabilidade de transmissão da doença. No entanto, sabendo-se que o isolamento de enteropatógenos nas fezes de crianças predispostas a este tipo de patologia não é maior do que nos controles e que a relação do patógeno isolado com o processo vigente é discutível, o emprego de antimicrobianos não é recomendado como rotina. Indica-se antibioticoterapia quando há comprovação bem estabelecida nos casos de infecção prolongada por Salmonella, Giardia, Cyclospora, Strongyloides e Escherichia coli enteroagregativa (neste último caso especialmente se a criança for menor de 3 meses de vida ou desnutrida, imunodeprimida ou apresentar sinais de doença invasiva). Na presença de sangue nas fezes está indicada antibioticoterapia nos casos comprovados de infecção por Shigella e Entamoeba hystolitica, ou seja, quando o patógeno é isolado nas fezes. A decisão de prescrever antibióticos deve ser considerada, portanto, à comprovação laboratorial do agente enteropatogênico nas fezes e ao tipo de resistência microbiana.
Profilaxia
No relatório apresentado pela Organização Mundial da Saúde de 2009, são propostas, além das 2 medidas terapêuticas acima mencionadas, para o controle da doença diarréica, 5 medidas preventivas, a saber: 1- vacinação contra o Rotavirus e o Sarampo; 2- promoção do aleitamento natural exclusivo e suplementação com vitamina A; 3- promoção da lavagem das mãos com sabão; 4- melhoria em qualidade e quantidade do suprimento de água, incluindo o tratamento da água estocada em casa; 5- universalização do saneamento básico.
As intervenções indicadas para diminuição da incidência da DP incluem aleitamento materno exclusivo e prolongado e estratégias seguras de alimentação para garantir adequado desenvolvimento pondero-estatural considerando-se que a desnutrição protéico-calórica é fator de risco para esta síndrome. Durante o episódio agudo são necessárias medidas para garantir a hidratação, suplementação de Zinco e a não interrupção da alimentação. Quando o episódio agudo se prolonga além de 7 dias, está-se frente ao que se denomina diarréia prolongada (Pro-D, com duração entre 7 e 13 dias), cuja epidemiologia ainda tem sido pouco estudada. Recentemente, no nordeste do Brasil (Fortaleza/Ceará), Moore e cols., em 2010 (Gastroenterology 139:1156-64), demonstraram que crianças que apresentam episódios prolongados de diarréia apresentam 2,2 vezes maior probabilidade de desenvolverem DP na sua infância tardia. Este risco aumentado ocorre pelo efeito da patologia sobre o estado nutricional, o sistema imunológico e pela indução de alterações na barreira intestinal ou alterações da flora intestinal.
No Brasil, várias medidas de caráter universal e que se tornaram consistentes desde o início dos anos 1990, tais como campanhas bem sucedidas de promoção da terapia de reidratação oral, a criação e consolidação do Sistema Único de Saúde, e, em particular a implantação do Programa de Saúde da Família, em 1994, possibilitaram alcançar uma considerável diminuição nas taxas de mortalidade associadas à diarréia nas crianças menores de 5 anos de idade.
Assim termino este fascinante capítulo da minha especialidade e logo mais iniciarei mais um excitante e importante tema, qual seja as manifestações digestivas causadas pela Síndrome da Imnodeficiência Adquirida (Sida) ou AIDS sigla em inglês que se consagrou em nosso meio da Syndrome of the Acquired Immune Deficiency.
Aproveito também o momento para agradecer aos meus leitores espalhados em mais 70 países do globo terrestre pela confiança em mim depositada e pelas palavras de apoio e estímulo. Desejo a todos vocês um Feliz Natal e um Ano Novo repleto de realizações com muita paz, saúde e amor. Que seus mais almejados e longínquos sonhos se transformem em doce realidade são os meus mais sinceros desejos.

 Figura 2- Teste de Sobrecarga com Lactose: não houve elevação da concentração do H2 no ar expirado após a sobrecarga em nenhum momento do teste.
Figura 2- Teste de Sobrecarga com Lactose: não houve elevação da concentração do H2 no ar expirado após a sobrecarga em nenhum momento do teste.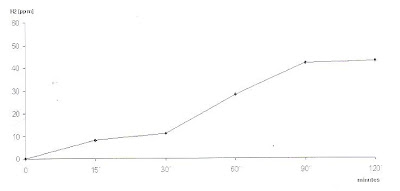
 Figura 4- Teste anormal de sobrecarga com Lactose: pico precoce (antes dos 60 minutos indicando Sobrecrescimento Bacteriano) e pico tardio concentração do H2 no ar expirado acima de 20 ppm sobre o nível de jejum (fermentação colônica).
Figura 4- Teste anormal de sobrecarga com Lactose: pico precoce (antes dos 60 minutos indicando Sobrecrescimento Bacteriano) e pico tardio concentração do H2 no ar expirado acima de 20 ppm sobre o nível de jejum (fermentação colônica). Figura 5- Material de biópsia de intestino delgado evidenciando atrofia vilositária sub-total e intenso infiltrado linfo-plasmocitário na lâmina própria.
Figura 5- Material de biópsia de intestino delgado evidenciando atrofia vilositária sub-total e intenso infiltrado linfo-plasmocitário na lâmina própria.
 Figura 7- Material de biópsia de intestino delgado evidenciando a presença de uma larva de Strongiloides stercoralis no interior da lâmina própria.
Figura 7- Material de biópsia de intestino delgado evidenciando a presença de uma larva de Strongiloides stercoralis no interior da lâmina própria. Figura 8- Vide legenda da foto.
Figura 8- Vide legenda da foto. Figura 9- Vide legenda da foto.
Figura 9- Vide legenda da foto.

 Figura 3- Estrutura química dos sais biliares primários e secundários.
Figura 3- Estrutura química dos sais biliares primários e secundários. Figura 4- Desenho esquemático da propriedade dos sais biliares de formar solução micelar.
Figura 4- Desenho esquemático da propriedade dos sais biliares de formar solução micelar. Figura 5- Desenho esquemático da formação da micela mista e da ação da lipase pancreática sobre as gorduras em condições fisiológicas.
Figura 5- Desenho esquemático da formação da micela mista e da ação da lipase pancreática sobre as gorduras em condições fisiológicas. Figura 6- Ruptura da barreira de permeabilidade intestinal induzida por sais biliares secundários sobre a mucosa jejunal de ratos submetidos a perfusão intestinal in vivo. Vide legenda das fotos do artigo abaixo.
Figura 6- Ruptura da barreira de permeabilidade intestinal induzida por sais biliares secundários sobre a mucosa jejunal de ratos submetidos a perfusão intestinal in vivo. Vide legenda das fotos do artigo abaixo.
 Figura 7- Vide descrição do gráfico.
Figura 7- Vide descrição do gráfico. Figura 8- Descrição esquemática da 7 alfa desidroxilação de um sal biliar primário por uma bactéria anaeróbia da flora colônica.
Figura 8- Descrição esquemática da 7 alfa desidroxilação de um sal biliar primário por uma bactéria anaeróbia da flora colônica. Figura 9- Descrição esquemática da beta hidroxilação de um ácido graxo por bactéria anaeróbia da flora colônica.
Figura 9- Descrição esquemática da beta hidroxilação de um ácido graxo por bactéria anaeróbia da flora colônica. Figura 10- Vide descrição do slide.
Figura 10- Vide descrição do slide. Figura 11- Vide descrição da tabela.
Figura 11- Vide descrição da tabela. Figura 12- Vide descrição da tabela.
Figura 12- Vide descrição da tabela. Figura 13 - Vide descrição da tabela.
Figura 13 - Vide descrição da tabela. Figura 1- Cepa de Escherichia coli em cultura de célula HeLa evidenciando adesão agregativa, tipicamente "em pilha de tijolos".
Figura 1- Cepa de Escherichia coli em cultura de célula HeLa evidenciando adesão agregativa, tipicamente "em pilha de tijolos".
 Figura 2- Cepa de Escherichia coli em cultura de célula HeLa evidenciando Adesão Difusa.
Figura 2- Cepa de Escherichia coli em cultura de célula HeLa evidenciando Adesão Difusa.
 Figura 3- Efeito citotóxico da cepa de Escherichia coli agregativa O42 sobre células carcinomatosas intestinais humanas.
Figura 3- Efeito citotóxico da cepa de Escherichia coli agregativa O42 sobre células carcinomatosas intestinais humanas.
 Figura 4- Vide texto no slide.
Figura 4- Vide texto no slide.

 Figura 6- Vide texto no slide.
Figura 6- Vide texto no slide.
 Figura 7- Vide texto no slide.
Figura 7- Vide texto no slide.
 Figura 8- Vide texto no slide.
Figura 8- Vide texto no slide.
 Figura 9- Vide texto no slide.
Figura 9- Vide texto no slide.
 Figura 10- Vide texto no slide.
Figura 10- Vide texto no slide.
 Figura 11- Vide texto no slide.
Figura 11- Vide texto no slide.
 Figura 1- Típica adesão localizada de uma cepa de Escherichia coli enteropatogênica em cultura de células HeLa.
Figura 1- Típica adesão localizada de uma cepa de Escherichia coli enteropatogênica em cultura de células HeLa. Figura 2- Ultramicrofotografia de uma Escherichia coli enteropatogênica e suas fímbrias.
Figura 2- Ultramicrofotografia de uma Escherichia coli enteropatogênica e suas fímbrias.
 Figura 4- Ultramicrofotografia de um enterócito demonstrando a característica lesão em pedestal.
Figura 4- Ultramicrofotografia de um enterócito demonstrando a característica lesão em pedestal. Figura 5- Modelo esquemático do mecanismo de patogenicidade da Escherichia coli enteropatogênica.
Figura 5- Modelo esquemático do mecanismo de patogenicidade da Escherichia coli enteropatogênica.
 FIgura 7- Microfotografia em maior aumento de material de biópsia de intestino delgado mostrando nichos de bactéria sobre o epitélio do intestino delgado.
FIgura 7- Microfotografia em maior aumento de material de biópsia de intestino delgado mostrando nichos de bactéria sobre o epitélio do intestino delgado. Figura 8- Microfotografia em corte semifino do intestino delgado evidenciando nichos de Escherichia coli O111:H2 firmemente aderidos à superfície epitelial dos enterócitos.
Figura 8- Microfotografia em corte semifino do intestino delgado evidenciando nichos de Escherichia coli O111:H2 firmemente aderidos à superfície epitelial dos enterócitos. Figura 9- Ultramicrofotografia de um enterócito evidenciando a presença microorganismos de Escherichia coli O111:H2 no seu interior.
Figura 9- Ultramicrofotografia de um enterócito evidenciando a presença microorganismos de Escherichia coli O111:H2 no seu interior. Figura 10- Ultramicrofotografia da infecção de uma célula HeLa pela cepa de Escherichia coli O111:H2. Notar a presença de um microorganismo no interior da célula e outro na porção apical da célula HeLa com formação de pedestal.
Figura 10- Ultramicrofotografia da infecção de uma célula HeLa pela cepa de Escherichia coli O111:H2. Notar a presença de um microorganismo no interior da célula e outro na porção apical da célula HeLa com formação de pedestal.


 Figura 4- O Microbiologista John Bray (esquerda), o Pediatra Thomas Beavan (centro) e o Biólogo J. Stevenson (direita) no dia da homenagem em 1968.
Figura 4- O Microbiologista John Bray (esquerda), o Pediatra Thomas Beavan (centro) e o Biólogo J. Stevenson (direita) no dia da homenagem em 1968.